Kinh Nghiệm Hướng dẫn Tất cả những sắt kẽm kim loại kiềm thổ đều tác dụng với nước ở Đk thường Mới Nhất
Pro đang tìm kiếm từ khóa Tất cả những sắt kẽm kim loại kiềm thổ đều tác dụng với nước ở Đk thường được Update vào lúc : 2022-05-10 22:06:15 . Với phương châm chia sẻ Bí quyết về trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi tìm hiểu thêm tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Mình lý giải và hướng dẫn lại nha.
Câu hỏi tiên tiến và phát triển nhất
Xem thêm »Nội dung chính
- Câu hỏi tiên tiến và phát triển nhất
- Câu hỏi tiên tiến và phát triển nhất
-

-

-

-

-

-

Cho hơi nước trải qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X trải qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
- Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất.
- Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất.
Giá trị của a là
-

-

-

-

X là este no, đơn chức, Y là axit cacboxylic đơn chức, không no chứa một link đôi C=C; Z là este 2 chức tạo bởi etylen glicol và axit Y (X, Y, Z, đều mạch hở, số mol Y bằng số mol Z). Đốt cháy a gam hỗn hợp E chứa X, Y, Z cần dùng 0,335 mol O2 thu được tổng khối lượng CO2 và H2O là 19,74 gam. Mặt khác, a gam E làm mất đi màu tối đa dung dịch chứa 0,14 mol Br2. Lượng của X trong E là
Câu hỏi tiên tiến và phát triển nhất
Xem thêm »
-

-

-

-

-

-

Cho hơi nước trải qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X trải qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
- Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất.
- Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất.
Giá trị của a là
-

-

-

-

X là este no, đơn chức, Y là axit cacboxylic đơn chức, không no chứa một link đôi C=C; Z là este 2 chức tạo bởi etylen glicol và axit Y (X, Y, Z, đều mạch hở, số mol Y bằng số mol Z). Đốt cháy a gam hỗn hợp E chứa X, Y, Z cần dùng 0,335 mol O2 thu được tổng khối lượng CO2 và H2O là 19,74 gam. Mặt khác, a gam E làm mất đi màu tối đa dung dịch chứa 0,14 mol Br2. Lượng của X trong E là
Kiềm thổ là sắt kẽm kim loại có tính chất hoá học và vật lý gần tương tự với sắt kẽm kim loại kiềm vì vậy mà thật nhiều bạn học viên dễ bị nhầm lẫn giữa 2 nhóm sắt kẽm kim loại này.
Trong nội dung bài viết này toàn bộ chúng ta cùng tìm hiểu sắt kẽm kim loại kiềm thổ là gì? kiềm thổ có tính chất hoá học và vật lý nào đặc trưng và nó khác gì so với sắt kẽm kim loại kiềm toàn bộ chúng ta đã tìm hiểu ở bài trước.
I. Vị trí cấu trúc của sắt kẽm kim loại kiềm thổ
Bạn đang xem: Tính chất hoá học của sắt kẽm kim loại Kiềm thổ, hợp chấp của kiềm thổ và bài tập – hoá 12 bài 26
– Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau sắt kẽm kim loại kiềm.
– Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti ( Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền).
– Cấu hình electron lớp ngoài cùng là: ns2 (với n là thứ tự lớp)
II. Tính chất vật lý của sắt kẽm kim loại kiềm thổ
– Màu sắc : sắt kẽm kim loại kiềm thổ có white color bạc hoặc xám nhạt, hoàn toàn có thể rát mỏng dính.
– Nhiệt độ nóng chảy và nhiệt độ sôi tuy có cao hơn sắt kẽm kim loại kiềm nhưng vẫn tương đối thấp
– Khối lượng riêng tương đối nhỏ, nhẹ hơn nhôm trừ Bari
– Độ cứng cao hơn sắt kẽm kim loại kiềm nhưng vẫn tương đối mềm
III. Tính chất hoá học của sắt kẽm kim loại kiềm thổ
– Các sắt kẽm kim loại kiềm thổ có tính khử mạnh, yếu hơn so với sắt kẽm kim loại kiềm. Tính khử của những sắt kẽm kim loại kiềm thổ tăng từ Be → Ba.
M – 2e → M2+
1. Kim loại kiềm thổ tác dụng với phi kim
– Khi đốt nóng trong không khí, những sắt kẽm kim loại kiềm thổ đều bốc cháy tạo oxit, phản ứng phát ra nhiều nhiệt.
2Mg + O2 → 2MgO
– Trong không khí ẩm Ca, Sr, Ba tạo ra lớp cacbonat (phản ứng với không khí như oxi) cho nên vì thế cần cất giữ những sắt kẽm kim loại này trong bình rất kín hoặc dầu hỏa khan.
– Khi đun nóng, toàn bộ những sắt kẽm kim loại kiềm thổ tương tác mãnh liệt với halogen, nitơ, lưu huỳnh, photpho, cacbon, siliC.
Ca + Cl2 → CaCl2
2Mg + Si → Mg2Si
– Do có ái lực to nhiều hơn oxi, khi đun nóng những sắt kẽm kim loại kiềm thổ khử được nhiều oxit bền (B2O3, CO2, SiO2, TiO2, Al2O3, Cr2O3,).
2Be + TiO2 → 2BeO + Ti
2Mg + CO2 → 2MgO + C
2. Kim loại kiềm thổ tác dụng với axit
a) HCl, H2SO4 (loãng) : Kim loại kiềm khử ion H+ thành H2
Mg + 2H+ → Mg2+ + H2↑
b) HNO3, H2SO4 đặc : Khử N+5, S+6 thành những hợp chất có mức oxi hoá thấp hơn.
4Ca + 10HNO3 (loãng) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đặc → Mg(NO3)2 + 2NO2↑ + 2H2O
4Mg + 5H2SO4 đặc → 4MgSO4 + H2S↑ + 4H2O
3. Kim loại kiềm thổ tác dụng với nước
– Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ:
Ca + 2H2O → Ca(OH)2 + H2↑
– Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
Mg + H2O → MgO + H2↑
– Be không tan trong nước dù ở nhiệt độ cao vì có lớp oxit bền bảo vệ. Nhưng Be hoàn toàn có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo berilat:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2↑
Be + 2NaOH(nóng chảy) → Na2BeO2 + H2↑
IV. Ứng dụng và điều chế sắt kẽm kim loại kiềm thổ
1. Ứng dụng của sắt kẽm kim loại kiềm thổ
– Kim loại Be: làm chất phụ gia để sản xuất sắt kẽm kim loại tổng hợp có tính đàn hồi cao, bền, chắc, không biến thành ăn mòn.
– Kim loại Ca: dùng làm chất khử để tách oxi, lưu huỳnh thoát khỏi thép, làm khô 1 số hợp chất hữu cơ.
– Kim loại Mg có nhiều ứng dụng hơn hết: tạo sắt kẽm kim loại tổng hợp có tính cứng, nhẹ, bền để sản xuất máy bay, tên lửa, ôtô… Mg còn được sử dụng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để sản xuất chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh.
2. Điều chế sắt kẽm kim loại kiềm thổ
– Trong tự nhiên, sắt kẽm kim loại kiềm thổ chỉ tồn tại dạng ion M2+ trong những hợp chất.
– Phương pháp cơ bản là điện phân muối nóng chảy của chúng.
CaCl2
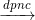 Ca + Cl2↑
Ca + Cl2↑
MgCl2
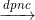 Mg + Cl2↑
Mg + Cl2↑
– Một số phương pháp khác:
+ Dùng than cốc khử MgO; CaO từ đolomit bằng febositic (hợp chất Si và Fe) ở nhiệt độ cao và trong chân không.
MgO + C → Mg + CO
CaO + 2MgO + Si → 2Mg + CaO.SiO2
+ Dùng nhôm hay magie khử muối của Ca, Sr, Ba trong chân không ở 11000C → 12000C.
2Al + 4CaO → CaO.Al2O3 + 3Ca
2Al + 4SrO → SrO. Al2O3 + 3Sr
2Al + 4BaO → BaO. Al2O3 + 3Ba
V. Một số hợp chất quan trọng Canxi – sắt kẽm kim loại kiềm thổ
1. Canxi oxit: CaO (Vôi sống)
– Tác dụng với nước, tỏa nhiệt : CaO + H2O → Ca(OH)2 ít tan.
– Với axit : CaO + 2HCl → CaCl2 + H2O
– Với oxit axit : CaO + CO2 → CaCO3 ( vôi chết )
2. Các hiđroxit M(OH)2 của những sắt kẽm kim loại kiềm thổ
a) Tính chất của những hidroxit
– Các hiđroxit M(OH)2 khan đều ở dạng white color.
– Tính tan: Be(OH)2; Mg(OH)2 rất ít tan trong nướC.
Ca(OH)2 tương đối ít tan ( 0,12g/100g H2O).
Các hiđroxit còn sót lại tan nhiều trong nướC.
– Độ bền nhiệt của hiđroxit tăng từ Be → Ba: Mg(OH)2 mất nước ở 150◦C; Ba(OH)2 mất nước ở 1000◦C tạo thành oxit.
– Tính bazơ: Be(OH)2 là bazơ rất yếu, Mg(OH)2 là bazơ trung bình, Ca(OH)2; Ba(OH)2; Sr(OH)2 là bazơ mạnh.
b) Canxi hidroxit : Ca(OH)2 (Vôi tôi)
– Ít tan trong nước : Ca(OH)2 → Ca2+ + 2OH–
– Với axít : Ca(OH)2 + 2HCl → CaCl2 + H2O
– Với oxit axit : Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + CO2 → Ca(HCO3)2
– Với d2 muối : Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
c) Ứng dụng của những hidroxit
– Hợp chất hidroxit sắt kẽm kim loại kiềm thổ Ca(OH)2 ứng dụng rộng tự do hơn hết :trộn vữa xây nhà ở, khử chua đất trồng, sản xuất cloruavôi dùng để tẩy trắng và khử trùng.
3. Canxi cacbonat (CaCO3) và Canxi hidro cacbonat Ca(HCO3)2
CaCO3 : Canxi cacbonat
Ca(HCO3)2 : Canxi hidro cacbonat
Với nước
Canxi cacbonat là chất rắn white color, không tan trong nước. nhưng tan trong amoniclorua:
CaCO3 + 2NH4Cl → CaCl2 + 2NH3↑ + CO2↑ + H2O
Tan trong nước:
Ca(HCO3)2 → Ca2+ + 2HCO3–
Với bazơ mạnh
Không phản ứng
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Với axit mạnh
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O
lưỡng tính
Nhiệt phân
Bị phân hủy ở nhiệt độ cao:
CaCO3 –t0→ CaO + CO2↑
Bị phân hủy khi đun nóng nhẹ:
Ca(HCO3)2 –t0→ CaCO3 + CO2↑ + H2O
Phản ứng trao đổi với
CO2 , PO43-
Không
Ca(OH)2 + CO2 → CaCO3↓ + H2O
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
Với CO2
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
không tan tan
Chiều thuận (1): Giải thích sự xâm thực của nước mưa riêng với đá vôi tạo hang động.
Chiều nghịch (2): Giải thích sự tạo thành thạch nhũ trong hang động.
4. Canxi sunfat (CaSO4)
a) Tính chất của canxi sunfat
– Là chất rắn white color tan ít trong nước (ở 25◦C tan 0,15g/100g H2O).
– Tùy theo lượng nước kết tinh trong muối sunfat, ta có 3 loại:
+ CaSO4.2H2O : thạch cao sống trong tự nhiên, bền ở nhiệt độ thường.
+ CaSO4.H2O hoặc CaSO4.0,5H2O : thạch cao nung (hemihiđrat)
+ CaSO4.2H2O → CaSO4.0,5H2O + 1,5H2O (125◦C)
– Đun nóng 200◦C; thạch cao nung thành thạch cao khan (CaSO4).
CaSO4.0,5H2O
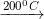 CaSO4 + ½H2O
CaSO4 + ½H2O
– CaSO4: không tan trong nước, không tác dụng với nước, chỉ phân hủy ở nhiệt độ rất cao.
2CaSO4
 2CaO + 2SO2 + O2
2CaO + 2SO2 + O2
b) Ứng dụng của canxi sunfat
– Thạch cao nung hoàn toàn có thể kết phù thích hợp với nước tao thành thạch cao sống và khi đông cứng thì giãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc bộ sưu tập rõ ràng tinh vi dùng trang trí thiết kế bên trong bên trong, làm phấn viết bảng, bó bột khi gãy xương,…
– Thạch cao sống dùng để sản xuất xi-măng.
5. Nước cứng
a) Khái niệm Nước cứng
– Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. Nước chứa ít hoặc không chứa những ion trên được gọi là nước mềm.
b) Phân loại nước cứng
– Căn cứ vào thành phần những anion gốc axit có trong nước cứng, người ta chia nước cứng ra 3 loại:
* Nước cứng trong thời điểm tạm thời: Tính cứng trong thời điểm tạm thời của nước cứng là vì những muối Ca(HCO3)2, Mg(HCO3)2 gây ra:
Ca(HCO3)2 → Ca2+ + 2HCO3–
– Goị là trong thời điểm tạm thời vì độ cứng sẽ mất đi khi đun sôi: M(HCO3)2 →MCO3 + CO2 + H2O
* Nước cứng vĩnh cửu: Tính cứng vĩnh cửu của nước là vì những muối CaCl2, MgCl2, CaSO4, MgSO4 gây ra, gọi là vĩnh cữu vì khi đun nóng muối này sẽ không còn phân hủy:
* Nước có tính cứng toàn phần: Là nước có cả tính cứng trong thời điểm tạm thời và vĩnh cửu.
– Nước tự nhiên thường có cả tính cứng trong thời điểm tạm thời và vĩnh cửu.
c) Tác hại của nước cứng
* Về mặt đời sống thường ngày:
– Giặt áo quần bằng xà phòng (natri stearat C17H35COONa) trong nước cứng sẽ tạo ra muối không tan là canxi stearat (C17H35COO)2Ca, chất này bán trên vải sợi, làm cho quần áo mau mục nát.
2C17H35COONa +MCl2 →(C17H35COO)2M$ +2NaCl
– Nước cứng làm cho xà phòng có ít bọt, giảm kĩ năng tẩy rửA.
– Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị do phản ứng của những ion và những chất trong thực phẩm.
* Về mặt sản xuất công nghiệp:
– Khi đun nóng,ở đáy nồi hay ống dẫn nước nóng sẽ gây nên ra lớp cặn đá kém dẫn nhiệt làm hao tổn chất đốt, gây nổ nồi hơi và ùn tắc ống dẫn nước nóng (không bảo vệ an toàn và uy tín).
– Làm hỏng nhiều dung dịch cần pha chế.
– Vì vậy, việc làm mềm nước cứng trước lúc sử dụng có y nghĩa rất quan trọng.
d) Các phương pháp làm mềm nước cứng
– Nguyên tắc làm mềm nước cứng là giảm nồng độ những cation Ca2+,Mg2+ trong nước cứng.
* Phương pháp kết tủa:
- Đối với nước có tính cứng trong thời điểm tạm thời
– Đun sôi nước có tính cứng trong thời điểm tạm thời trước lúc sử dụng, muối hiđrocacbonat chuyển thành muối cacbonat không tan:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 → MgCO3↓ + CO2↑ + H2O
⇒ Lọc bỏ kết tủa được nước mềm.
– Dùng một khối lượng vừa đủ dung dịch Ca(OH)2, Na2CO3 để trung hòa muối hiđrocacbonat thành muối cacbonat kết tủA. Lọc bỏ chất không tan, được nước mềm:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2 + 2CaCO3 + 2H2O
M(HCO3)2 + Na2CO3 → MCO3 + 2NaHCO3
- Đối với nước có tính cứng vĩnh cửu:
– Dùng dung dịch Na2CO3, Ca(OH)2 và dung dịch Na3PO4 để làm mềm nước cứng:
Ca2+ + CO32- → CaCO3↓
3Ca2+ + 2PO43- → Ca3(PO4)2↓
Mg2+ + CO32- + Ca2+ + 2OH– → Mg(OH)2↓ + CaCO3↓
* Phương pháp trao đổi ion:
– Phương pháp trao đổi ion được sử dụng phổ cập để làm mềm nướC. Phương pháp này nhờ vào kĩ năng trao đổi ion của những hạt zeolit (những alumino silicat kết tinh, có trong tự nhiên hoặc được tổng hợp, trong tinh thể có chứa những lỗ trống nhỏ) hoặc nhựa trao đổi ion.
– Thí dụ: Cho nước cứng trải qua chất trao đổi ion là những hạt zeolit thì số mol ion Na+ của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho những ion Ca2+ và Mg2+ bị giữ lại trong mạng tinh thể silicat.
VI. Bài tập về Kim loại kiềm thổ
Bài 2 trang 119 SGK Hóa 12: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không có hiện tượng kỳ lạ gì.
* Lời giải bài 2 trang 119 SGK Hóa 12:
- Đáp án: A.Có kết tủa trắng.
– PTPƯ: Ca(OH)2 + Ca(HCO3)2
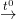 2CaCO3 + H2O
2CaCO3 + H2O
Bài 3 trang 119 SGK Hóa 12: Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối (CaCO3 , MgCO3) trong hỗn hợp là :
A. 35,2 % và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% và 14,51%.
D. 17,6% và 82,4%.
* Lời giải bài 3 trang 119 SGK Hóa 12:
- Đáp án: B.70,4% và 29,6%.
– Gọi x, y lần lượt là số mol của CaCO3 và MgCO3 trong hỗn hợp
ta có: 100x + 84y = 2,84 (1)
– Phương trình hoá học của phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
x (mol) x
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
y (mol) y
– Theo bài ra, Số mol CO2: nCO2 = 0,672/22,4 = 0,03 (mol)
– Theo PTPƯ: nCO2 = x + y = 0,3 (2)
– Giải hệ PT (1) và (2) ta được, x = 0,02 (mol) và y = 0,01 (mol)
⇒ %mCaCO3 = [(0,02.100)/2,84].100% = 70,42%
⇒ %mMgCO3 = 100% – 70,42% = 29,58%
Bài 4 trang 119 SGK Hóa 12: Cho 2g sắt kẽm kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là sắt kẽm kim loại nào sau này?
A. Be. B. Mg. C. Ca. D. Ba.
Lời giải bài 4 trang 119 SGK Hóa 12:
– Gọi M là sắt kẽm kim loại nhóm II, số mol là x, ta có: Mx = 2 (1)
– Phương trình hoá học của phản ứng:
M + 2HCl → MCl2 + H2↑
x (mol) x
– Theo PTPƯ ta có: (71+M)x = 5,55 (2)
– Giải hệ PT (1) và (2) ta được: x = 0,05 và M = 40
⇒ M là Ca
Bài 5 trang 119 SGK Hóa 12: Cho 2,8 g CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2(đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Lời giải bài 5 trang 119 SGK Hóa 12:
a) Theo bài ra, ta có số mol CaO là: nCaO = 2,8/56 = 0,05 (mol)
Số mol CO2 là nCO2 = 1,68/22,4 = 0,075 (mol)
– Phương trình hoá học của phản ứng:
CaO + H2O → Ca(OH)2
0,05 (mol) 0,05 (mol)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 0,05 0,05 (mol)
– Theo PTPƯ: nCaCO3 = nCO2 pư = nCa(OH)2 = 0,05 mol
⇒ nCO2 dư = 0,075 – 0,05 = 0,025 (mol)
– CaCO3 tạo thành 0,05 (mol) bị hòa tan 0,025 (mol)
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,025 0,025 0,025 (mol)
⇒ Số mol CaCO3 còn sót lại là: 0,05 – 0,025 = 0,025 (mol)
⇒ Khối lượng CaCO3 là: mCaCO3 = 0,025. 100 = 2,5 (g)
b) Khi đun nóng dung dịch A
Ca(HCO3)2
 CaCO3↓ + CO2 + H2O
CaCO3↓ + CO2 + H2O
0,025 0,025 (mol)
⇒ Khối lượng kết tủa tối đa thu được là: mCaCO3 = (0,025 + 0,025).100 = 5 (g)
Bài 6 trang 119 SGK Hóa 12: Khi lấy 14,25g muối clorua của một sắt kẽm kim loại chỉ có hóa trị II và một lượng muối nitrat của sắt kẽm kim loại đó có số mol bằng số mol muối clorua thì thấy rất khác nhau 7,95g. Xác định tên sắt kẽm kim loại
* Lời giải bài 6 trang 119 SGK Hóa 12:
– Gọi sắt kẽm kim loại cần tìm là M, có hóa trị là II
⇒ Công thức muối clorua là MCl2, có số mol là x
Ta có PT: (M + 71)x = 14,25 (1)
⇒ Công thức muối nitrat là M(NO3)2.
Ta có PT: (M + 124)x = 14,25 + 7,95 (2)
– Giải hệ PT (1) và (2) ta được, x = 0,15, M = 24
⇒ M là Mg
Bài 7 trang 119 SGK Hóa 12: Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc). Xác định số gam mỗi muối trong hỗn hợp.
* Lời giải bài 7 trang 119 SGK Hóa 12:
– Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
⇒ 100x + 84y = 8,2 (1)
– Theo bài ra, ta có: nCO2 = 2,016/22,4=0,09 (mol)
– Phương trình hoá học của phản ứng:
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
– Theo PTPƯ: nCO2 = x + y = 0,09 (2)
– Giải hệ PT gồm (1) và (2) ta được, x = 0,04 và y = 0,05
⇒ mCaCO3 = 0,04.100 = 4 (g)
⇒ mMgCO3 = 0,05.84 = 4,2 (g)
Bài 8 trang 119 SGK Hóa 12: Trong một cốc nước có chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3–, 0,02 mol Cl–. Nước trong cốc thuộc loại nào ?
A. Nước cứng có tính cứng trong thời điểm tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
* Lời giải bài 8 trang 119 SGK Hóa 12:
- Đáp án: C. Nước cứng có tính cứng toàn phần.
– Cốc nước trên chứa những ion: Ca2+, Mg2+, HCO3–, Cl–
⇒ Thuộc nước cứng toàn phần (có cả tính cứng trong thời điểm tạm thời và tính cứng vĩnh cửu)
Bài 9 trang 119 SGK Hóa 12: Viết phương trình hóa học của phản ứng để lý giải việc dùng Na3PO4 để làm mềm nước cứng có tính cứng toàn phần.
* Lời giải bài 9 trang 119 SGK Hóa 12:
– Các phương trình hoá học của phản ứng
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4.
– Khi đó toàn bộ những ion Ca2+, Mg2+ đều kết tủa hết dưới dạng muối photphat => làm mềm được nước cứng toàn phần.
Hy vọng với nội dung bài viết khối mạng lưới hệ thống lại kiến thức và kỹ năng về tính chất hoá học của sắt kẽm kim loại kiềm thổ, những hợp chất quan trọng của sắt kẽm kim loại kiềm thổ và bài tập vận dụng ở trên hữu ích cho những em. Mọi góp ý và vướng mắc những em hãy để lại phản hồi dưới nội dung bài viết để được tương hỗ, chúc những em học tập tốt.
¤ Xem thêm những nội dung bài viết khác tại:
Đăng bởi: THPT Sóc Trăng
Chuyên mục: Giáo Dục
 Reply
Reply
 9
9
 0
0
 Chia sẻ
Chia sẻ
Chia Sẻ Link Down Tất cả những sắt kẽm kim loại kiềm thổ đều tác dụng với nước ở Đk thường miễn phí
Bạn vừa tìm hiểu thêm tài liệu Với Một số hướng dẫn một cách rõ ràng hơn về Clip Tất cả những sắt kẽm kim loại kiềm thổ đều tác dụng với nước ở Đk thường tiên tiến và phát triển nhất và Chia Sẻ Link Cập nhật Tất cả những sắt kẽm kim loại kiềm thổ đều tác dụng với nước ở Đk thường Free.



